Bateria (eletricidade)

VEJA TAMBÉM: Como funciona uma BATERIA
Quatro baterias double-A
Em ciência e tecnologia, a bateria é um dispositivo que armazena energia e torna disponível de forma elétrica. Embora tal armazenamento de forma eletrostática é prática em alguns usos especializados (em um capacitor), as baterias geralmente consistem de dispositivos eletroquímicos, como uma ou mais células galvânicas ou, mais recentemente, células de combustível, e pode, no futuro uso de outras tecnologias. A indústria de bateria vale 2,8 bilhões de dólares anualmente.
Em um sentido técnico, pode ser feita a distinção entre
- um elétrica da bateria , um dispositivo para criar ou armazenar energia elétrica composto por vários semelhantes (geralmente idênticas) células que estão ligados entre si, contra
- um eléctrica célula , uma única unidade tal, possivelmente, uma célula em um (estrito-terminologia) da bateria de múltiplas células ou, eventualmente, todo o dispositivo.
Essa distinção, no entanto, é considerado pedante na maioria dos contextos (exceto a expressão de célula seca ), e no uso de Inglês atual é mais comum chamar uma única célula usado sozinho uma bateria de um celular .
Um exemplo é uma bateria duplo A (AA). Mesmo que a maioria das pessoas chamam isso de uma bateria, na realidade, é uma célula (como são as outras denominações letras, embora muitas vezes se ouve a "célula D" mais-correto ou "célula C"). A bateria do carro é uma "bateria" true porque ele usa várias células dentro dela que são ligados entre si em série, formando assim uma bateria. Do mesmo modo, uma bateria de 9 volt é uma bateria verdadeira, tal como deve conter mais de uma célula.
História
Há alguma evidência de-sob a forma de as baterias de Bagdá a partir de algum momento entre 250 aC e 640 dC-de células galvânicas tendo sido utilizado nos tempos antigos para galvaniza objetos de metal de base com um metal precioso. Tal conhecimento antigo na história da eletricidade não tem qualquer relação contínua conhecido para o desenvolvimento de baterias modernas. A conjectura de que esses dispositivos tinham uma função elétrica, enquanto plausível, ainda não foi provado.
Em 1748, Benjamin Franklin inventou o termo bateria para descrever o capacitor simples ele experimentou, o que foi uma série de placas de vidro carregadas. Ele adaptou a palavra de seu sentido mais cedo que significa uma surra , que é o que um choque elétrico do aparelho sentia. Naqueles dias, o efeito divertido de um choque elétrico foi um dos poucos usos da tecnologia. Outros pesquisadores fizeram baterias a partir de um número de garrafas de Leyden conectados em paralelo. A definição foi posteriormente ampliado para incluir uma variedade de células eletroquímicas ou capacitores. A pilha voltaica foi uma bateria química desenvolvido por Alessandro Volta em 1800. Volta pesquisou os efeitos que diferentes metais produzidos quando exposto à água salgada. Em 1801, Volta demonstrou a célula voltaica a Napoleão Bonaparte (que mais tarde enobreceu-lo por suas descobertas). Luigi Galvani pesquisado o mesmo efeito com duas peças do mesmo metal exposto à água salgada.
A comunidade científica neste momento chamado Estas baterias pilhas . A bateria foi chamado de um acumulador , porque realizada carga, ou um órgão elétrico artificial . Alguns pesquisadores iniciais sobre baterias chamado o dispositivo de uma célula gravidade porque a gravidade manteve os dois sulfatos separados. O nome célula aranha também foi utilizada por causa da forma do eléctrodo de zinco utilizada nas baterias.
Em 1800, William Nicholson e Anthony Carlisle usou uma bateria para decompor a água em hidrogênio e oxigênio. Humphry Davy pesquisado este efeito químico ao mesmo tempo. Davy pesquisou a decomposição de substâncias (chamado eletrólise). Em 1813, ele construiu uma bateria de 2.000 pares de placa no porão da Royal Society da Grã-Bretanha, que abrange 889 m² (83 m²). Através desta experiência, Davy deduziu que a eletrólise foi a ação na pilha voltaica que produziu eletricidade. Em 1820, o pesquisador britânico John Frederic Daniell melhorou a célula voltaica. A célula de Daniell consistiu de placas de cobre e de zinco e de cobre e de zinco sulfatos. Ele foi usado para operar telégrafos e campainhas. Entre 1832 e 1834, Michael Faraday realizou experimentos com um anel de ferrite, um galvanômetro, e uma bateria conectada. Quando a bateria foi ligado ou desligado, o galvanômetro desviado. Faraday desenvolveu também o princípio da mobilidade iónica em reacções químicas de baterias. Em 1839, William Robert Grove desenvolveu a primeira célula de combustível, que produziu energia elétrica através da combinação de hidrogênio e oxigênio. Grove desenvolveu uma outra forma da célula elétrica usando zinco e platina eletrodos. Estes eléctrodos foram expostas a dois ácidos separadas por um diafragma.
Na década de 1860, Georges Leclanché da França desenvolveram uma bateria de zinco-carbono. Era uma cela úmida, com eletrodos mergulhados em um corpo de líquido eletrólito. Era robusto, fabricado facilmente, e teve uma vida útil decente. Uma versão melhorada chamada de célula seca posterior foi feita por meio de selagem a célula e mudando o electrólito fluido a uma pasta húmida. A célula Leclanché é um tipo de bateria principal (não-recarregáveis). Na década de 1860, Raymond Gaston Plante inventou a bateria de chumbo-ácido. Ele imerso duas placas de chumbo sólidas finas separadas por folhas de borracha em uma solução de ácido sulfúrico diluído, para se fazer um (recarregável) da bateria secundária. A invenção original tinha uma vida útil curta, porém. Por volta de 1881, Émile Alphonse Faure, com seus colegas, desenvolveu baterias usando uma mistura de óxidos de chumbo para a chapa de eletrólito positivo. Estes tiveram reações mais rápidas e maior eficiência. Em 1878, a bateria de célula de ar foi desenvolvido. Em 1897, Nikola Tesla pesquisou uma célula de carboneto de leve e uma célula de armazenamento de oxigênio-hidrogênio. Em 1898, Nathan Stubblefield recebeu a aprovação de uma patente de bateria (US600457): esta patente bobina eletrolítico é referido como uma "bateria de terra".
Em 1900, Thomas Edison desenvolveu a bateria de armazenamento de níquel. Em 1905, Edison desenvolveu a bateria de níquel-ferro.Como todas as células eletroquímicas, Edison produziu uma corrente de elétrons que fluíam em uma única direção, conhecida como corrente contínua. Na Segunda Guerra Mundial, Samuel Ruben e Philip Rogers Mallory desenvolveu a célula de mercúrio. Na década de 1950, Russell S. Ohl desenvolveu um wafer de silício que produziu elétrons livres. Na década de 1950, Ruben melhorou a bateria alcalina de manganês. Em 1954, Gerald L. Pearson, Daryl M. Chapin, e Calvin S. Fuller produzido um conjunto de várias dessas bolachas, fazendo a primeira bateria solar ou célula solar. Em 1956, Francis Bacon Thomas desenvolveu a célula de combustível de hidrogênio-oxigênio. Em 1959, Lewis Urry desenvolveu a bateria alcalina pequena no laboratório Eveready Battery Company, em Parma, Ohio. Na década de 1960, pesquisadores alemães inventaram uma bateria de chumbo-ácido eletrólito tipo gel. Duracell foi formada em 1964.
Células caseiros
Quase qualquer objeto líquido ou húmido que tem de ser suficientes iões eletricamente condutor pode servir como o eletrólito para uma célula. Como novidade ou ciência demonstração, é possível inserir dois eletrodos em um limão , batata, copo de refrigerante, etc. e gerar pequenas quantidades de eletricidade. A partir de 2005 , os "relógios de dois batata" estão amplamente disponíveis em hobby e lojas de brinquedos; eles consistem de um par de células, cada uma composta de uma batata com dois eléctrodos inseridos nele, ligadas em série para formar uma bateria com uma tensão suficiente para abastecer um relógio digital. Caseiros células deste tipo não são de nenhum uso prático real, porque eles produzem muito menos corrente e custam muito mais por unidade de energia gerada por que as células comerciais.
O futuro
A pesquisa inicial indica que nanotecnologia baterias empregando nanotubos de carbono terá o dobro da vida útil das baterias tradicionais modernos.
Uma nova forma de bateria está em desenvolvimento chamado Livro de energia. Esta bateria fina, flexível vem sob a forma de células de tinta, que pode ser impresso em que praticamente toda a superfície e produzir energia .
Componente elétrico
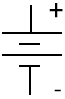
Símbolo do circuito por uma bateria (sinais + e - são opcionais)
As células de uma bateria pode ser ligada em paralelo ou em série, ou ambos. Uma combinação em paralelo das células tem a mesma tensão de uma única célula, mas pode fornecer uma corrente mais elevada (a soma das correntes a partir de todas as células). Por outro lado, uma combinação em série tem a mesma classificação de corrente como uma única célula, mas a sua tensão é a soma das voltagens de todas as células. A maioria das baterias eletroquímicas práticos, tais como lanterna 9 volts (tocha) e baterias de 12 V do automóvel (carro) baterias, tem uma estrutura de série. Arranjos paralelos sofrem do problema de que, se uma célula descarrega mais depressa do que o seu vizinho, a corrente irá fluir a partir da célula total para a célula vazia, o desperdício de energia e possivelmente causando um sobreaquecimento. Pior ainda, se uma célula torna-se curto-circuito devido a uma falha interna, seu vizinho será forçado a cumprir a sua corrente máxima na célula defeituosa, levando ao superaquecimento e possivelmente explosão. As células em paralelo são, portanto, geralmente equipado com um circuito eletrônico para protegê-los contra esses problemas. Em ambos os tipos de séries e paralllel, a energia armazenada na bateria é igual à soma das energias armazenadas em todas as células.
Uma bateria pode ser modelado como uma fonte de tensão perfeita (isto é, com uma resistência interna de zero) em série com uma resistência. A fonte de tensão, depende principalmente da composição química da bateria, não se é vazio ou cheio. Quando a bateria se esgota, sua resistência interna aumenta. Quando a bateria estiver ligado a uma carga (por exemplo, uma lâmpada de luz), que tem a sua própria resistência, a tensão resultante através da carga depende da razão entre a resistência interna da bateria para a resistência da carga. Quando a bateria é fresco, a sua resistência interna é baixa, de modo que a voltagem através da carga é quase igual ao da fonte de tensão interna da bateria. À medida que a bateria se esgota e os seus aumentos de resistência interna, a proporção de sua tensão interna que recebe através da resistência interna a aparecer na carga fica menor, então a capacidade da bateria para fornecer energia para a carga diminui.
Tipos de pilhas comuns

várias baterias
Do ponto de vista de um usuário, pelo menos, as baterias podem ser geralmente divididos em dois tipos principais - recarregáveis ??e não-recarregáveis ??(descartáveis). Cada um é no uso de largura.
Baterias descartáveis, também chamados de células primárias , destinam-se a ser utilizado, uma vez, até que as mudanças químicas que induzem o fornecimento de corrente eléctrica são completo, altura em que a bateria é descartado. Estes são mais comumente usados ??em dispositivos menores, portáteis ou com baixa fuga de corrente, utilizado apenas de forma intermitente, ou usado bem longe de uma fonte de energia alternativa. Veja também: resíduos.
Em contraste, as baterias recarregáveis ??ou células secundárias pode ser recarregada depois de terem sido drenados. Isto é feito através da aplicação de corrente eléctrica fornecida externamente, que faz com que as mudanças químicas que ocorrem em uso para ser invertida. Dispositivos para suprir a corrente apropriada são chamados carregadores ou carregadores.
A forma mais antiga de bateria recarregável ainda no uso moderno é a bateria de chumbo-ácido molhado celular. Esta bateria é notável na medida em que contém um líquido em um recipiente sem lacre, exigindo que a bateria seja mantida de pé ea área ser bem ventilado para lidar com os gases explosivos de oxigênio e hidrogênio, que são exalados por estas baterias durante sobrecarga. A bateria de chumbo-ácido também é muito pesado para a quantidade de energia elétrica que pode fornecer. Apesar disso, seu baixo custo de produção e os seus níveis atuais de alta de onda que o seu uso comum, onde o peso e facilidade de manuseio não são preocupações.
Uma forma comum de bateria de chumbo-ácido é a bateria do carro moderno. Isto pode produzir cerca de 10.000 watts de potência a uma tensão nominal de 12 volts (embora a verdadeira tensão de circuito aberto está mais perto de 13,7 V) e tem uma saída de corrente de pico que varia 450-1100 ampères. Eletrólito da bateria é ácido sulfúrico, que pode causar ferimentos graves se entrarem na pele ou olhos.
Um tipo mais caro de bateria de chumbo-ácido chamado de bateria gel (ou "célula gel") contém um eletrólito semi-sólido para evitar o derramamento. Mais baterias recarregáveis ??portáteis incluem vários tipos de células "seca", que são unidades seladas e são, portanto, útil em aparelhos como telefones celulares e laptops. As células deste tipo (em ordem crescente de densidade de potência e custo) incluem células (Li-Ion) de níquel-cádmio (NiCd ou NiCd), de níquel metal hidreto (NiMH) e lítio-íon.
Tamanhos de bateria comum
Células descartáveis ??vêm em vários tamanhos normalizados, de modo que o mesmo tipo de pilha pode ser utilizado numa vasta variedade de aparelhos. Alguns dos principais tipos utilizados em aparelhos portáteis estão listados abaixo:
| EU | IEC | ANSI | Outro | Forma | Tensão |
| N | LR1 | 910A | senhora | cilindro L 30,2 milímetros, D 12 milímetros | 1.5 V |
| AAAA |
| 25A | MN2500 | L cilindro 42 mm, D 8 milímetros | 1.5 V |
| AAA | LR03 | 24A | R03, MN2400, AM4, UM4, Pr16, micro | cilindro L 44,5 milímetros, D 10,5 milímetros | 1.5 V |
| AA | LR6 | 15A | R6, MN1500, AM3, UM3, HP7, mignon | L cilindro 50 mm, D 14,2 milímetros | 1.5 V |
| A |
|
| abastecimento de filamento em receptores de rádio início | vários tamanhos de prismas rectangulares. | 1,5 V, 6 V |
| B |
|
| fornecimento placa em receptores de rádio início | prisma retangular vários tamanhos, muitas vezes com torneiras. | 45 V, 60 V, 90 V, etc. |
| C |
|
| fornecimento de polarização de grade em receptores de rádio início | prisma retangular vários tamanhos, muitas vezes com várias torneiras. | 4.5 V, 6 V, 9 V, etc. |
| C | LR14 | 14A | R14, UM2, MN1400, HP11, baby | L cilindro 43 mm, D 23 milímetros | 1.5 V |
| D | LR20 | 13A | R20, MN1300, UM1, HP2, mono | L cilindro 58 mm, D 33 milímetros | 1.5 V |
| F |
|
|
| cilindro L 87 mm D 32 milímetros | 1.5 V |
| G |
|
|
| cilindro L 105 mm, D 32 milímetros | 1.5 V |
| J |
|
|
| cilindro L 150 mm, D 32 milímetros | 1.5 V |
|
| 3R12 |
| GP312S | prisma rectangular 67 milímetros x 62 milímetros x 22 milímetros | 4.5 V |
|
|
|
| lanterna, 996 | prisma retangular 68 milímetros quadrados × 115 milímetros | 6 V (nota) |
| PP3 | 6LR61 | 1604A | 6F22,6R61, MN1604 | rectangular prisma 48 milímetros × 25 mm × 15mm | 9 V (nota) |
| PP9 | 6F100 | 1603 |
| 51,6 milímetros prisma retangular × 65,1 milímetros × 80,2 milímetros de alta | 9 V (nota) |
|
| 4R25X | 908 | MN908 | quadrados prisma de 110 mm × 67,7 milímetros quadrados, terminais de mola | 6 V (nota) |
|
| 4R25 | 915 |
| prisma quadrado de 110 mm × 67,7 milímetros quadrados, terminais de parafuso | 6 V (nota) |
|
| 4LR25-2 | 918A | MN918 | prisma retangular 127 milímetros × 136,5 milímetros × 73 milímetros de altura, terminais de parafuso | 6 V (nota) |
|
|
|
| PC926 | prisma retangular 127 milímetros × 136,5 milímetros × 73 milímetros de altura, terminais de parafuso | 12 V (nota) |
Nota: 6 V, 9 V, e 12 V baterias são comumente feito usando vários 1,5 V células colocadas em série. Veja célula eletroquímica .
A norma europeia relevante é IEC 60086-1 baterias primárias - Parte 1: Geral ( BS397 no Reino Unido).
A norma US relevante é ANSI C18.1 Padrão Nacional Americano para pilhas secas e baterias de Especificações .
Uma extensa série de artigos em muitos aspectos de pilhas e à sua utilização em equipamento portátil está disponível ao Buchmann.ca ( http://www.buchmann.ca/ ) .
Resumo
Descartável
- Zinco-carbono bateria
- Bateria alcalina
- Bateria de óxido de prata
- Bateria de lítio
- Zinc-air bateria
Recarregável
- Bateria de chumbo-ácido
- Bateria Gel
- Bateria NiCd
- Bateria NiMH
- Li-ion
- Bateria Li-Polymer
- Bateria NaS
A capacidade da bateria
A capacidade de uma bateria para armazenar a carga é freqüentemente expressa em ampères horas (1 A · h = 3600 pingentes ). Se uma bateria podem fornecer um ampères (1 A) da corrente (fluxo) durante uma hora, ele tem uma real capacidade de 1 A · h. Se ele pode fornecer um A, durante 100 horas, a sua capacidade é de 100 A · h. Do mesmo modo, 20 A durante 2 horas é igual a 40 A · h capacidade. Mas A ...
Enquanto uma bateria que pode entregar 10 A durante 10 horas pode ser dito para ter uma capacidade de 100 A · h, que é não como a classificação é determinada pelos fabricantes. A 100 A · bateria h Classificado provavelmente não vai entregar 10 A por 10 horas. Os fabricantes da bateria usar um método padrão para determinar como para avaliar as suas baterias. A sua classificação baseia-se em testes realizados ao longo de 20 horas, com uma taxa de descarga de 1/20 (5%) da capacidade da bateria esperado. Assim, uma bateria 100 ampères-hora é classificado para proporcionar 5 Um durante 20 horas. A eficiência de uma bateria é diferente em diferentes taxas de descarga. Quando se descarrega a 1/20 da sua capacidade, as baterias são mais eficientes do que a taxas mais elevadas de descarga.
Para calcular a taxa de descarga 5% de uma bateria, leve o fabricante amperagem horas e dividir por 20. Por exemplo, você tem um celular AA avaliado em 1.300 mA h (miliamperes horas). A taxa de alta de 5% a partir do qual essa classificação foi derivada seria 1.300 mA · h / 20 h = 65 mA.
Explosão da bateria
Em condições extremas, certos tipos de baterias podem explodir violentamente. A explosão da bateria geralmente é causado pelo mau uso ou mau funcionamento de uma bateria (como a recarga de uma bateria não recarregável ou curto-circuito uma bateria de carro).
Com baterias de carros, explosões são mais prováveis ??de ocorrer quando um curto-circuito gera correntes de muito alta magnitude. A avaria de curto-circuito em uma bateria colocada em paralelo com outras baterias ("saltou") pode causar o seu vizinho para descarregar sua corrente máxima na célula defeituosa, levando ao superaquecimento e uma possível explosão.
Quando uma bateria não recarregável é recarregada a uma taxa elevada, uma mistura explosiva de gás de hidrogênio e oxigênio podem ser produzidos mais rápido do que ele pode escapar de dentro dos muros da bateria, levando ao acúmulo de pressão e uma possível explosão. Em casos extremos, o ácido da bateria pode pulverizar violentamente a partir do invólucro da bateria e causa lesão.
Além disso, a alienação de uma bateria no fogo pode causar uma explosão em forma de vapor acumula-se dentro da caixa selada da bateria.
Sobrecarga, que é carregar uma bateria além de sua capacidade elétrica, também pode levar a uma explosão da bateria, vazamento ou danos irreversíveis à bateria. Ele pode também causar danos ao carregador ou dispositivo em que a bateria está sobrecarregado usado mais tarde.
Links externos
- Eletroquímica Enciclopédia BATERIAS não recarregáveis
- Bateria Glossário e Terminologia ( http://www.windsun.com/batteries/battery_Glos.htm )
- Battery Technologies ( http://www.freeenergynews.com/Directory/Battery/index.html ) - página Diretório cobrindo teoria, pesquisa e desenvolvimento, e dispositivos de mercado que melhorem a tendência para a energia limpa e renovável. (FreeEnergyNews )
- Computadores a jato , um olhar para as futuras tecnologias de baterias por Fred Hapgood (http://hotwired.wired.com/wired_online/4.10/batteries/index.html )
- A microturbina , tecnologia de bateria como "The Next Big Thing", de Fred Hapgood (http://fhapgood.fastmail.fm/microturbine.htm )
- Exide Technologies, fabricante típico de baterias para aplicações industriais e outros ( http://www.exide.com/ )
- Baterias em um mundo portátil - um manual sobre baterias recarregáveis ??para não-engenheiros (http://www.buchmann.ca/default.asp ) - tem uma seção FAQ abrangente sobre baterias recarregáveis
- Lanterna
Lanterna verde A lanterna ou tocha é um portátil de mão elétrico holofotes. Isso é conhecido como uma lanterna principalmente no Estados Unidos e Canadá e como uma tocha na maioria dos Commonwealth países. A lanterna típico consiste de um pequeno...
- Alessandro Volta - Biografia
Alessandro Volta (1745 - 1827) Alessandro Volta (1745 - 1827) Físico italiano - inventou a bateria. Alessandro Giuseppe Antonio Anastasio Volta foi um físico italiano, que nasceu a 18 de fevereiro de 1745, tendo falecido na mesma cidade a 5 de março...
- Johann Ritter - Biografia
Johann Ritter (1776 - 1810) Johann Ritter (1776 - 1810) Descoberta dos ultravioletas. Johann Ritter foi um químico e físico alemão responsável pela descoberta da faixa ultravioleta do espectro eletromagnético, pela criação do protótipo da pilha...
- Célula De Combustível
As células de combustível movidos a hidrogênio, um combustível que pode ser feita por qualquer indivíduo ou nação que tem um fornecimento de água e energia elétrica, o que significa que há pouca chance de monopolização ou de fixação de...
- História Da Eletricidade
Foi descoberta por um filosofo grego chamado Tales de Mileto que, ao esfregar um âmbar a um pedaço de pele de carneiro, observou que pedaços de palhas e fragmentos de madeira começaram a ser atraídas pelo próprio âmbar. Do âmbar (gr. élektron)...
