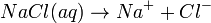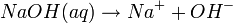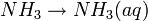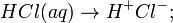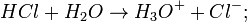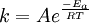Arrhenius Svante - Biografia
Svante Arrhenius ( 1859 - 1927 )

Svante Arrhenius
(1859 - 1927)
Contribuiu de forma decisiva para o avanço da química
Svante August Arrhenius foi um químico sueco, nasceu no dia 19 de fevereiro de 1859, em Vik, e faleceu aos 68 anos, em Estocolmo, no dia 2 de outubro de 1927).
Recebeu o prémio Nobel da Química de 1903, "em reconhecimento dos serviços extraordinários concedidos ao avanço da Química pela sua teoria electrolítica da dissociação".
Entrou aos 8 anos na escola da Catedral de Vik, tendo proeminência em física e matemática, sendo o aluno mais jovem a graduar-se em 1876. A sua família mudou-se para a cidade de Upsala, e ele entrou na Universidade da mesma cidade quando tinha 17 anos. Posteriormente estudou na Universidade de Estocolmo. Ensinou classes de física na Escola Técnica Superior desta Universidade (1891-1895), alcançando o grau de catedrático na mesma (1895-1904). Em 1904 passou a dirigir o Instituto Nobel de Química e Física (1905-1927).
Sendo estudante, preparando-se para o doutoramento na Universidade de Upsala, investigou as propriedades condutoras das dissoluções eletrolíticas, que formulou na sua tese. A sua teoria afirma que nas dissoluções eletrolíticas, os compostos químicos dissolvidos, se dissociam em iões, mantendo a hipótese de que o grau de dissociação aumenta com o grau de diluição da solução, o que se verificou ser válido apenas para os eletrólitos fracos. Acreditando que a teoria estava errada, a sua tese foi aprovada com a qualificação mínima possível. Esta teoria foi objeto de muitos ataques, especialmente por Lord Kelvin, sendo apoiada por Jacobus Van't Hoff, em cujo laboratório havia trabalhado como bolsista estrangeiro (1886-1890), e por Wilhelm Ostwald.
Posteriormente esta teoria foi aceite por todos, convertendo-se num dos pilares da físico-química, no ramo da eletroquímica. Sua concepção científica valeu-lhe a obtenção do Nobel de Química de 1903, "em reconhecimento dos extraordinários serviços prestados ao avanço da química através de sua teoria da dissociação eletrolítica?.
Além disso, trabalhou em diversos ramos da físico-química, como velocidade das reações, sobre a prática da imunização e sobre astronomia. Como consequência, em 1889, descobriu que a velocidade das reações químicas aumenta com a temperatura, numa relação proporcional com a concentração de moléculas existentes.
Em 1909 foi membro estrangeiro da Royal Society. Em 1911, durante uma visita aos Estados Unidos, foi condecorado com o primeiro Prémio Willard Gibbs e, em 1914, recebeu o Prémio Faraday Lectureship.
Teoria de Arrhenius
Trabalhando na Universidade de Upsala Arrhenius realizou numerosas experiências com a passagem de corrente elétrica através de solução aquosa, e formulou a hipótese de que algumas substâncias continham partículas carregadas, os iões.
- De Acordo com Arrhenius, determinadas substâncias quando dissolvidas em meio aquoso sofriam separação de iões preexistentes, o que tornava a substância condutora de eletricidade. Um exemplo clássico é o do sal de cozinha (NaCl) ou da soda cáustica (NaOH):
- Quando um composto molecular era dissolvido em meio aquoso, não conduzia eletricidade pois não formava iões, o resultado era uma solução molecular; um bom exemplo é a dissolução do amoníaco.
Porém, Arrhenius observou que uma ligação covalente de hidrogénio e cloro, de modo a formar ácido clorídrico também conduzia eletricidade em meio aquoso. A conclusão foi que, como o HCl contém uma ligação covalente, os iões são formados por meio da quebra dessas moléculas por água, o que origina uma solução iónica. Esse fenómeno foi denominado ionização.
De facto, estas equações são uma representação simplificada. O fenómeno da ionização ocorre pela reação entre o ácido clorídrico e as moléculas de água
Normalmente, omitimos a participação da água.
Equação de Arrhenius
A Equação de Arrhenius permite calcular a variação da constante de velocidade de uma reação química com a temperatura. É uma equação bastante utilizada na cinética química, onde é utilizada também para a determinação da energia de ativação de reações. A Equação de Arrhenius é determinada por:
Onde:
k = constante de velocidade;
A = constante pré-exponencial (depende da área de contato entre outros fatores);
Ea = Energia de ativação;
R = constante dos gases;
T = Temperatura;
Referências:
http://pt.wikipedia.org/wiki/Equa%C3%A7%C3%A3o_de_Arrhenius
http://pt.wikipedia.org/wiki/Svante_Arrhenius
- Gilbert Lewis - Biografia
Gilbert Lewis ( 1875 - 1946 ) Gilbert Newton Lewis (1875 - 1946) Desenvolveu o conceito de ligação química Gilbert Newton Lewis nasceu no dia 23 de Outubro de 1875 em Weymouth, e distinguiu-se como químico Norte-Americano. Acabou por falecer na...
- Jacobus Van`t Hoff - Biografia
Jacobus van`t Hoff (1852 - 1911) Jacobus van`t Hoff (1852 - 1911) Primeiro a receber o nobel da química Jacobus Henricus van't Hoff foi um químico holandês que nasceu no dia 30 de agosto de 1852, em Roterdão, tendo falecido em Berlim, no dia...
- Gerhard Herzberg - Biografia
Gerhard Herzberg (1904 - 1999) Gerhard Herzberg (1904 - 1999) Trabalhou essencialmente em espectroscopia Gerhart Herzberg foi um físico alemão nascido em 1904, em Hamburgo, no dia 25 de dezembro, faleceu no dia 3 de março de 1999. Teve um irmão mais...
- Johann Von Baeyer - Biografia
Johann von Baeyer (1835 - 1917) Johann von Baeyer (1835 - 1917) Descoberta da fenolftaleína Johann Friedrich Wilhelm Adolf von Baeyer foi um químico alemão que nasceu em Berlim, no dia 31 de outubro de 1835, tendo falecido em Starnberg,...
- Amedeo Avogadro - Biografia
Amedeo Avogadro (1776 - 1856) Amedeo Avogadro (1776 - 1856) O advogado que gostava de ciências. Lorenzo Romano Amedeo Carlo Avogadro, também conhecido por conde de Quaregna e Cerreto, nasceu no dia 9 de Agosto de 1776 em Turim, tendo falecido na mesma...