André Marie Ampère - Biografia
André Marie Ampère (1775 - 1836)

André Marie Ampère (1775 - 1836)
Físico e matemático Francês
André Marie Ampère foi um físico e um matemático francês que nasceu em Lyon a 20 de Janeiro de 1775, no seio de uma família abastada. O seu pai, Jean-Jacques Ampère, transmitiu-lhe sólidos conhecimentos linguísticos e incentivou-o a cultivar uma postura autodidata.
Foi professor de física, química e matemática em Lyon (1797-1802) e em Bourg (1802-1804) e lecionou matemática e mecânica na École Polytechnique de Paris (1804-1828). Pela sua reputação como óptimo professor e investigador, em 1828 foi convidado para lecionar matemática na Université de France, cargo que ocupou até ao final da sua vida.
Para além de ser um extraordinário professor, Ampère desenvolveu trabalhos muito importantes nos campos da física, química e da matemática. Entre 1807 e 1816, estabeleceu a diferença entre átomos e moléculas, enunciou o chamado "princípio de Avogadro", descobriu um ácido ao qual deu o nome de Fluorine, publicou uma tese sobre a refração da luz e concebeu uma classificação de elementos, precursora da tabela periódica de elementos.
Ao tomar conhecimento das experiências de Hans Christian Oersted (1777-1851) sobre o desvio de agulhas magnéticas por efeito de uma corrente elétrica, Ampère começou a estudar os fenómenos eletromagnéticos e apresentou várias experiências no campo do eletromagnetismo à Academie de Paris. Em 1820 reconheceu que, sem a intervenção de qualquer íman, dois fios exercem um sobre o outro uma ação atrativa ou repulsiva consoante o sentido das correntes que os percorrem.
Em 1822 descobriu o princípio da telegrafia elétrica. No decurso das suas investigações sobre a eletricidade fez importantes descobertas. Experimentou a mútua influência entre fios condutores paralelos, distinguiu entre a intensidade de corrente que circula num condutor e a força impulsora ou tensão eletromagnética e concebeu o solenóide.
A sua teoria foi fundamental para o desenvolvimento da eletricidade e do magnetismo no século XIX. A sua obra mais importante, "Mémoire sur la Théorie Mathématique des Phénomènes Electrodynamiques" (1826) tornou possível os posteriores avanços de Thomson, Maxwell, Weber e Faraday no campo do eletromagnetismo.
Apesar das tragédias da sua vida pessoal (o seu pai foi guilhotinado em 1793 e a sua esposa faleceu em 1803, após um brevíssimo matrimónio), Ampère demonstrou grande empenho e dedicação. Como reconhecimento do seu valor, Napoleão nomeou-o inspetor-geral de instrução pública em 1808.
Faleceu a 10 de Junho de 1836, em Marselha. O Ampère (A) é hoje a unidade de medida da intensidade da corrente elétrica em sua homenagem.
Referências:
www.history.mcs.st-andrews.ac.uk/history/Mathematicians/Ampere.html
www.gap.dcs.st-and.ac.uk/~history/Mathematicians/Ampere.html
A Tabela periódica dos elementos químicos

Dmitri Mendeleiev
(1834 - 1907)
Dmitri Mendeleiev nasceu na Sibéria e destacou-se na história da Química pois resolveu ordenar os elementos químicos então conhecidos, numa tabela, após verificar que as suas propriedades se repetiam de forma periódica.
Esta tabela de Mendeleiev tinha algumas vantagens sobre outras tabelas ou teorias antes apresentadas, mostrando semelhanças numa rede de relações vertical, horizontal e diagonal. A classificação de Mendeleiev deixava ainda espaços vazios, prevendo a descoberta de novos elementos.
A tabela de Mendeleiev serviu de base para a elaboração da tabela periódica atual, que além de catalogar os 118 elementos conhecidos, fornece inúmeras informações sobre o cada um deles.
Veja a Tabela Original no Final da Postagem
Mais de metade dos elementos hoje conhecidos foram descobertos entre 1800 e 1900. Durante esse período, os químicos verificaram que certos elementos apresentavam grandes semelhanças.
A constatação da existência de regularidades periódicas nas propriedades físicas e químicas, aliada à necessidade de sistematizar toda a informação disponível, levou ao desenvolvimento da chamada Tabela Periódica dos Elementos.
Para saber mais sobre a evolução da tabela periódica - clique aqui
A tabela periódica dos elementos, na sua versão moderna apresenta o seguinte aspeto:
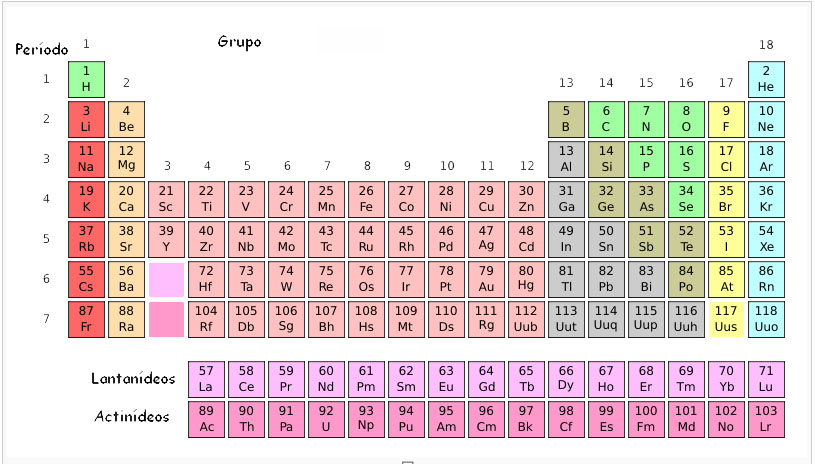
Os elementos encontram-se ordenados pelo seu número atómico (indicado nesta tabela por cima do respetivo símbolo) em sequências horizontais que se chamam períodos, e ao mesmo tempo em sequências verticais que se chamam grupos ou famílias. Alguns grupos mantêm nomes próprios, como se pode ver através da figura seguinte:
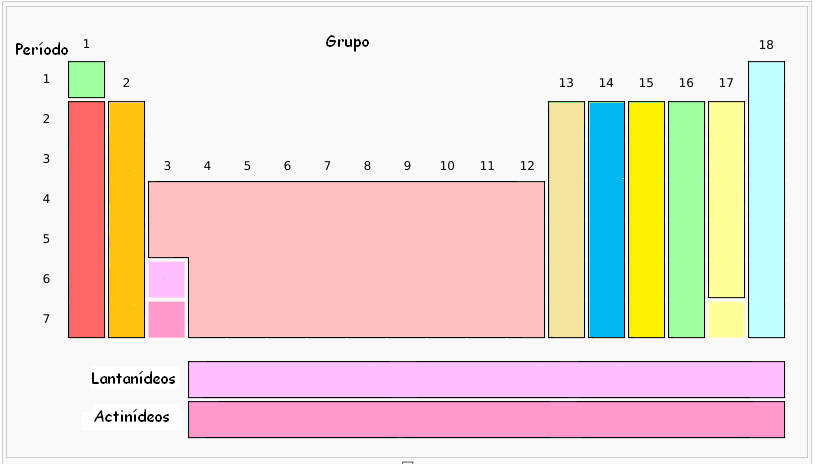
Os grupos, ou famílias da Tabela periódica, são constituídos da seguinte forma:
-
O primeiro grupo é designado por grupo dos metais alcalinos (com exceção do Hidrogénio (H)).
-
O segundo grupo denomina-se grupo dos metais alcalino-terrosos.
-
O conjunto dos grupos, entre o grupo 3 e o grupo 12 chamam-se metais de transição.
-
O grupo 13 é designado por família do Boro.
-
O grupo 14 é designado por família do Carbono.
-
O grupo 15 também se pode chamar família do Azoto.
-
O grupo 16 pode denominar-se família dos Calcogéneos.
-
O grupo 17 é designado usualmente por família dos Halogéneos.
-
O grupo 18 muito conhecido, apresenta os nomes de família dos gases raros, gases inertes ou ainda gases nobres.
-
As duas últimas linhas da tabela periódica são também designadas por família dos lantanídeos e dos actinídeos, como se pode observar na primeira figura apresentada.
Os períodos da Tabela periódica, são constituídos da seguinte forma:
-
O primeiro período é formado por dois elementos - Hidrogénio (H) e Hélio (He).
-
O segundo e o terceiro períodos contêm oito elementos cada um.
-
O quarto e o quinto períodos contêm dezoito elementos cada um.
-
O sexto período contém trinta e dois elementos.
-
O sétimo período é atualmente constituído por 32 elementos.
-
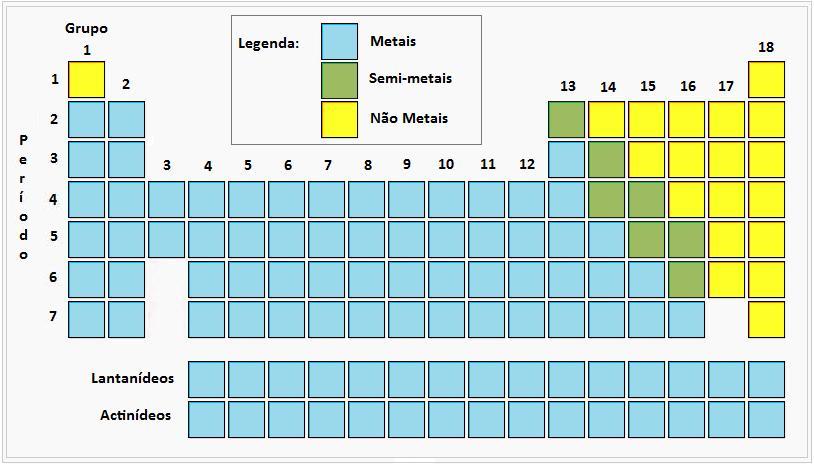
Os elementos químicos podem também classificar-se em três categorias:
METAIS
Bons condutores de calor e de eletricidade
Geralmente sólidos à temperatura ambiente
NÃO - METAIS
Maus condutores de calor e de eletricidade
Menor uniformidade nas suas propriedades do que os metais
SEMI - METAIS
Propriedades intermédias entre os metais e os não-metais
Na tabela periódica, dispõem-se da seguinte forma:
No 9º Ano estudas em particular três destes grupos da tabela periódica. São eles:
- os metais alcalinos (grupo 1)
- os halogéneos (grupo 17)
- os gases raros (grupo 18)
Vamos então ver de seguida alguns exemplos, assim como as suas características e as reações mais conhecidas.
Metais Alcalinos

Li
Lítio

Na
Sódio

K
Potássio

Rb
Rubídio
Características dos metais alcalinos
- São muito reativos. Por isso, não existem livres na natureza.
- Reagem em contato com o oxigénio do ar e com a água.
- Devem ser guardados em parafina líquida ou petróleo.
- As soluções aquosas resultantes das reações destas substâncias com a água são alcalinas.
Reações dos metais alcalinos
Os metais alcalinos reagem com a água, formando hidróxidos e libertando-se hidrogénio.
Reação do Lítio:
2 Li(s) + 2 H2O (l) ---> 2 LiOH (aq) + H2 (g)
Reação do sódio:
2 Na(s) + 2 H2O (l) ---> 2 NaOH (aq) + H2 (g)
Reação do potássio:
2 K(s) + 2 H2O (l) ---> 2 KOH (aq) + H2 (g)
Os metais alcalinos também reagem com o oxigénio.
Halogéneos

F
Flúor

Cl
Cloro

Br
Bromo

I
Iodo
Características dos halogéneos
- Aparecem na natureza sob a forma de moléculas diatómicas (F2, Cl2, Br2, I2).
- Reagem facilmente com os metais alcalinos, formando halogenetos.
- São mais solúveis no éter ou no óleo alimentar do que em água.
Reação de formação dos halogenetos:
Os halogéneos reagem com os metais alcalinos, formando-se compostos iónicos que se designam por halogenetos:
Cloro + Sódio ---> Cloreto de sódio
Cl2(g) + 2 Na (s) ---> 2 NaCl (s)
Bromo + Sódio ---> Brometo de sódio
Br2(g) + 2 Na (s) ---> 2 NaBr (s)
Iodo + Sódio ---> Iodeto de sódio
I2(g) + 2 Na (s) ---> 2 NaI (s)
Gases nobres, raros ou inertes

He
Hélio

Ne
Néon

Ar
Árgon

Kr
Krípton
Características dos gases raros, gases nobres ou gases inertes
- São gases à temperatura ambiente.
- Aparecem na natureza sob a forma de átomos isolados.
- Existem em quantidades relativamente pequenas, por isso são considerados raros.
- Não reagem com as outras substâncias, por isso se chamam inertes.
As regularidades na tabela periódica
De um modo geral, o tamanho dos átomos aumenta ao longo de um grupo, à medida que o seu número atómico aumenta. Mas, o tamanho dos átomos também diminui ao longo de um período.
Os átomos dos elementos do primeiro grupo (grupo dos metais alcalinos) têm um eletrão de valência (isto é, um eletrão no último nível de energia preenchido). Por isso, têm tendência a formar iões monopositivos.
Os átomos dos elementos do segundo grupo possuem dois eletrões de valência, pelo que, originam iões dipositivos.
Os átomos dos elementos do grupo 16, apresentam seis eletrões de valência, pelo que dão origem a iões dinegativos (iões com duas cargas negativas).
Os átomos que pertencem ao grupo 17 (família dos halogéneos) têm sete eletrões de valência, pelo que originam iões mononegativos.
Os átomos que pertencem ao grupo 18, denominados gases raros, são átomos estáveis, apresentam os seus níveis de energia completamente preenchidos, e por isso não originam iões. Aparecem na natureza sob a forma de átomos isolados.
Referências:
http://pt.wikipedia.org/wiki/Hist%C3%B3ria_da_tabela_peri%C3%B3dica
Manuais escolares do 9º ano
Tabela Original
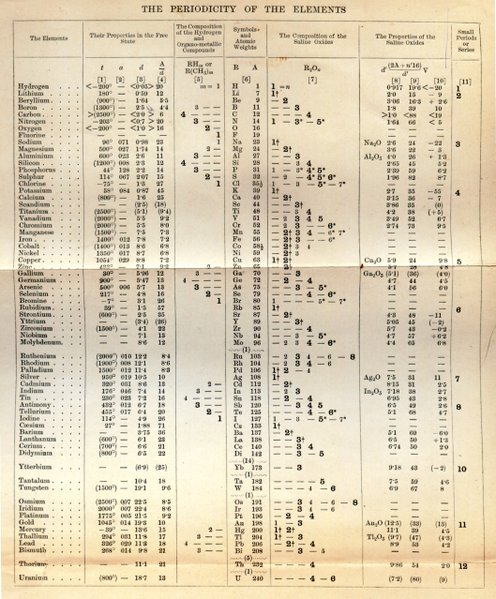
- William Ramsay - Biografia
William Ramsay (1852 - 1916) Sir William Ramsay (1852 - 1916) Descoberta da maioria dos gases raros. Sir William Ramsay foi um químico escocês que nasceu em Glasgow, a 2 de outubro de 1852, tendo falecido em High Wycombe, Buckinghamshire,...
- John Newlands - Biografia
John Newlands (1837 - 1898) John Newlands (1837 - 1898) Químico inglês John Newlands foi um químico inglês que nasceu a 26 de novembro de 1837, em Southwark, Londres, estudou no Royal College of Chemistry e faleceu a 29 de julho de 1898. Precedeu...
- Henry Moseley - Biografia
Henry Moseley (1887 - 1915) Henry Moseley (1887 - 1913) Físico inglês Henry Gwin-Jeffreys Moseley foi um físico inglês que nasceu em Weymouth, a 23 de novembro de 1887, tendo falecido em Gallipoli, no dia 10 de agosto de 1915. Estudou em Oxford,...
- Dmitri Mendeleiev - Biografia
Dmitri Mendeleiev (1834 - 1907) Dmitri Mendeleiev (1834 - 1907) Destacou-se na organização da Tabela Periódica Dmitri Mendeleiev nasceu na cidade de Tobolsk na Sibéria a 8 de fevereiro de 1834, tendo falecido a 2 de fevereiro de 1907...
- Amedeo Avogadro - Biografia
Amedeo Avogadro (1776 - 1856) Amedeo Avogadro (1776 - 1856) O advogado que gostava de ciências. Lorenzo Romano Amedeo Carlo Avogadro, também conhecido por conde de Quaregna e Cerreto, nasceu no dia 9 de Agosto de 1776 em Turim, tendo falecido na mesma...
